- La fosforilación oxidativa se define como la formación de ATP generada por la transferencia de
electrones. Todas las rutas catabólicas, en los organismos aerobios, convergen para permitir el
flujo de electrones hasta el oxígeno, produciendo energía para la generación de ATP constituyendo la etapa final del catabolismo de todas las biomoléculas.
- Proceso por el que se forma ATP como resultado de la transferencia de electrones desde el NADH o del FADH2 al O2 a través de una serie de transportadores electrónicos.
- Se define "fosforilación" como la síntesis de ATP a partir de ADP y fosfato.
- La fosforilación oxidativa es la transferencia de electrones de los equivalentes reducidos NADH, NADPH, FADH, obtenidos en la glucólisis y en el Ciclo de Krebs hasta el oxígeno molecular, acoplado con la síntesis de ATP.
- Proceso metabólico está formado por un conjunto de enzimas complejas que catalizan varias reacciones de óxido-reducción, donde el oxígeno es el aceptor final de electrones y donde se forma finalmente agua.
- Comienza con la entrada de e en la cadena respiratoria.
- De una molécula de glucosa se obtienen 38 moléculas de ATP mediante la fosforilación oxidativa.
- La fosforilación oxidativa es la transferencia de electrones de los equivalentes reducidos NADH, NADPH, FADH, obtenidos en la glucólisis y en el Ciclo de Krebs hasta el oxígeno molecular, acoplado con la síntesis de ATP.
- Proceso metabólico está formado por un conjunto de enzimas complejas que catalizan varias reacciones de óxido-reducción, donde el oxígeno es el aceptor final de electrones y donde se forma finalmente agua.
- Comienza con la entrada de e en la cadena respiratoria.
- De una molécula de glucosa se obtienen 38 moléculas de ATP mediante la fosforilación oxidativa.
- Hay 2 mecanismos diferentes de fosforilación:
- A nivel de sustrato: En los que una molécula fosforilada cede su fosfato al ADP.
- Quimiósmoticos: En los que la síntesis de ATP está acoplada al movimiento exergónico de hidrogeniones a favor de su potencial electroquímico.
- Fosforilación = Adición de un grupo fosfato o Pi (fósforo inorgánico) a una molécula orgánica.
- Fosforilación oxidativa = Donde el Pi proviene de reacciones redox como ocurre en la respiración celular aerobia y anaerobia.
Cadena respiratoria
La cadena respiratoria está formada por 2
procesos:
- El transporte de electrones, que se Lleva a cabo en la cadena transportadora de electrones (proceso exergónico que genera un gradiente de protones).
- El mecanismo de la fosforilación oxidativa proceso endergónico acoplado al anterior
Dicho acoplamiento energético
ocurre,
como ya conocemos, en la membrana interna de
la mitocondria.
Reacciones de óxido-reducción
Estas reacciones tienen lugar cuando hay una
transferencia de electrones desde un dador, denominado reductor hasta un aceptor que se denomina
oxidante.
Dador electrónico (reductor) <--> electrón + aceptor electrónico (oxidante)
Los elementos que participan en estas reacciones pueden encontrarse en dos formas: oxidada
y reducida formando un par redox conjugado.
Forma oxidada + electrón <--> Forma reducida
¿Dónde ocurre?
¿Dónde ocurre?
Membrana interna mitocondrial
Eponimo
- Peter Mitchell
- Teoría quimiósmotica
- 1961
En 1961 Peter Mitchell propuso la hipótesis quimiósmotica en la cual propuso que el intermediario energético necesario para la formación del ATP (o Fosforilación del ADP), era una diferencia en la concentración de protones a través de la membrana. Gracias a estas observaciones Mitchell recibió en premio Nobel de Química en 1978. Murió al final de la década de los 80's.
Precursores
- NADH
- FADH
- Complejos I ,II, III, IV y V
Cadena transportadora de electrones
- Es un sistema de transferencia
de hidrógenos y electrones catalizada por
proteínas enzimáticas ordenadas en forma
secuencial en la membrana mitocondrial interna.
Donde la energía libre necesaria para generar ATP se extrae de la oxidación del
NADH y del NADH2 mediante
una sucesión de cuatro complejos proteicos a través de los cuales pasan los
electrones.
Complejo I (NADH-Deshidrogenasa o NADH coenzima Q reductasa). Es el más grande y contiene, a su vez, 3 subfracciones. Una es insoluble en agua, la llamada HP, a la que quedan asociados los fosfolípidos que forman parte de este complejo I. Ninguna de sus proteínas es catalítica. Las otras 2 subfracciones, la FP y la IP, son solubles en agua. La FP es la que contiene la flavoproteína catalítica. Las 3 subfracciones contienen las diferentes proteínas Fe-S. La función del complejo les la de oxidar al NADH y reducir la Co Q.
- Cuando el complejo I recibe los electrones del NADH, 4 protones son expulsados al espacio intermembranal y los transfiere a la coenzima Q.
- Requiere de componentes intermediarios, como el flavin-mononucleotido (FMN), los centros Fe-S, y la ubiquinona (CoQ), los cuales acarrean los electrones a través de el complejo.
Complejo II (Succinato-deshidrogenasa o succinato-coenzima Q reductasa). Contiene la enzima dimérica del ciclo del ácido cítrico succinato deshidrogenasa y otras tres subunidades hidrofobicas pequeñas, pasa los electrones del succinato deshidrogenasa a CoQ.
- Recibe los electrones de moléculas con potencial redox mayor que el NADH, como ejemplo el succinato, y los transporta a la coenzima Q.
- El FADH2 proviene de la beta oxidación de los lípidos o de la glucólisis puede transmitir sus electrones a la UQ a través de enzimas, sin necesidad de utilizar el complejo II.
- Contiene FAD y 2 centros Fe-S.
Se da por dos pasos, llamados Ciclo Q.
PRIMER PASO:
La enzima se une a tres sustratos.
Los dos protones liberados de QH2 pasan al espacio intermembranal.
El tercer sustrato es la Q, la cual acepta el segundo electrón.
SEGUNDO PASO:
1. Una segunda molécula de QH2 es unida y de nuevo pasa su primer electrón al aceptor citocromo c.
2. El QH2 es liberado de la enzima.
3. Hay una transferencia neta de electrones a través de la membrana.
Complejo IV (citocromo c oxidasa). Cataliza las oxidaciones, con un electrón de cuatro moléculas consecutivas de citocromo c reducido y la reducción concomitante , con cuatro electrones , de una molécula de O2.
Complejo IV (citocromo c oxidasa). Cataliza las oxidaciones, con un electrón de cuatro moléculas consecutivas de citocromo c reducido y la reducción concomitante , con cuatro electrones , de una molécula de O2.
- Transfiere lo electrones del citocromo c y los utiliza para formar moléculas de agua a partir de oxigeno.
- Contiene cobre y citocromos con centros de hierro los cuales transfieren electrones a una molécula de oxigeno.
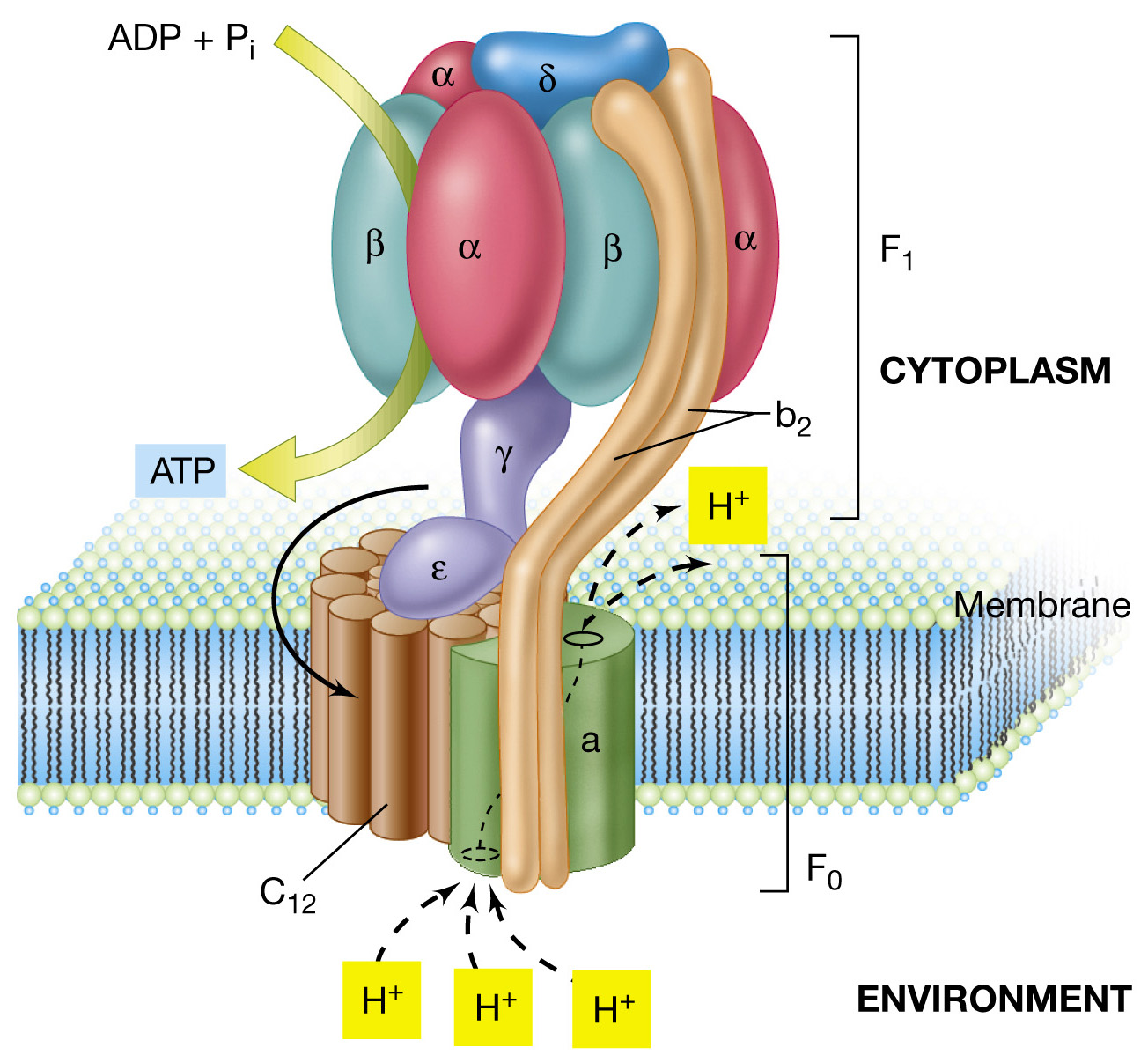
El complejo ATP sintetasa es una enzima encargada de
sintetizar Adenosina Trifosfato (ATP) a partir de ADP y un grupo fosfato,
merced a la energía suministrada por un flujo de protones, de acuerdo con la
hipótesis quimiosmótica de Mitchell. La ATP sintetasa se puede imaginar como un
motor molecular que produce una gran cantidad de ATP cuando los protones fluyen
a través de ella. La tasa de síntesis es grande, el organismo humano en fase de
reposo puede formar unas 1021 moléculas de ATP por segundo.
1. La síntesis de ATP, acoplada a la
energía que brinda el
gradiente de protones, y que se forma durante el transporte de electrones.
2. La hidrólisis de ATP, al acoplarse a la
traslocación de protones de la matriz al citosol, con
el paso de los cationes como el K', Na*,
Ca".
El complejo V lo forman 3 porciones: la cabeza,
la base y el cuello.
La cabeza, actualmente conocida
como
subunidad F1,
en
ellas
se localiza la actividad de síntesis de ATP. Están unidas por unos tallos,
el
cuello, a la membrana, donde se encuentra
la tercera parte que se corresponde
con la base. Esta ultima
es
la
subunidad F0, también conocida como el canal de protones, por
donde estos pasan al disiparse el gradiente durante
el mecanismo de formación del ATP.
- Unidad catalitica F1 = Contiene los sitios de fijación de ATP y ADP e interviene en las reacciones catalíticas de ATP. Compuesta por 5 subunidades distintas α, β, δ, ε, γ.
- Unidad bombeadora de H+ o F0 = Segmento hidrofobico que atraviesa la membrana interna mitocondrial. Formado por 10 a 14 subunidades de c, dos subunidades de b y una subunidad en la periferia del anillo.
- La ATP sintasa no precisa del gradiente de protones para generar ATP.
- El movimiento de protones a través de ATP sintasa es necesario para la liberación del ATP de F1.
- Se propone que la energía liberada durante el movimiento de protones a través de la membrana, produce un cambio confomacional de la ATP sintasa, que da lugar a la liberación del ATP unido fuertemente a la subunidad β.
- La interconversión entre las 3 formas puede ser dirigida mediante la rotación de y. Por cada rotación de 120º de y se da la liberación de ATP y la unión de un nuevo ADP+Pi.
- La rotación de y es producida por el paso de protones a través de la subunidad a, que produce una rotación del anillo de subunidades c.
- Mecanismo de rotación del anillo c: Cada protón entra por el semiconducto citosólico, sigue una vuelta completa por el anillo c y sale por el otro semiconducto hacia la matriz.
Inhibidores
- Barbitúricos: Amobarbital, inhiben el transporte de electrones por medio del complejo I.
- Antimicina y Dimercaprol: inhiben la cadena respiratoria en el complejo III.
- Monoxido de carbono y cianuro: inhiben el complejo IV, y en consecuencia pueden detener por completo la respiración.
- Malonato: inhibidor competitivo del complejo II.
- Atractilosido: inhibe la Fosforilación oxidativa mediante la inhibición del transportador de ADP hacia dentro de la mitocondria, y de ATP hacia afuera de ella.
- Oligomicina: bloquea por completo la oxidación y Fosforilación al bloquear el flujo de protones por medio de la ATP sintasa.
Regulación de la Fosforilación Oxidativa
La velocidad con que se desarrolla la fosforilación oxidativa está marcada por las necesidades
energéticas de la célula. Para que el proceso se realice de forma correcta se requiere un aporte
de sustratos como NADH (o FADH2), O2, ADP y Pi siendo el más importante el ADP. La concentración
intracelular de este metabolito es una medida de las necesidades de energía metabólica,
y, por lo tanto, va a fijar la velocidad a la que ha de desarrollarse la fosforilación oxidativa.
Esta regulación por ADP se denomina control respiratorio, ya que el consumo de O2 por parte
de la mitocondria, es dependiente de la cantidad de ADP presente.
Según la actividad celular desarrollada, se producirá un consumo mayor o menor de ATP, generándose
cantidades variables de ADP. Una concentración elevada de ADP causará un incremento
en la velocidad de la respiración celular o fosforilación oxidativa, intentando de manera
continua reequilibrar la relación ATP/ADP, o expresado bajo otros términos, la síntesis de ATP
se realiza según va siendo requerido por las necesidades celulares.
Todas las rutas catabólicas estudiadas tienen una regulación acoplada a la fosforilación oxidativa,
que se realiza a través de la carga energética; de tal manera, que hay un engranaje correcto
y equilibrado entre todos los procesos productores de energía con el consumo de la misma.
Productos del metabolismo
- 38 moléculas de ATP
Ciclos metabólicos con los que se relaciona:
Ciclos metabólicos con los que se relaciona:
- Glucólisis
- Descarboxilación del piruvato
- Ciclo de Krebs
Patología:
- Neuropatía óptica hereditaria de Leber (LHON):
- Rara enfermedad génetica transmitida por la madre.
- La causan mutaciones en el DNA.
- Afecta el SNC, incluidos nervios ópticos, causando pérdida de visión bilateral; se manifiesta tempranamente al inicio de la adolescencia.
- Signos: Inflamación de la papila óptica, tortuosidad vascular, telangiectasias peripapilares, microangiopatía y escotomas centrales en estudio del campo visual.