Conceptos básicos de termodinámica
Físico-química: Rama de la ciencia que estudia y desarrolla los principios que gobiernan las propiedades y el comportamiento de los sistemas químicos. Se divide en 4 áreas; Termodinámica, Química Cuantica, Mécanica estadística y Cinética.
Materia: Todo aquello que tiene masa y ocupa un lugar en el espacio.
Reacciones redox: Los elementos que forman las sustancias involucradas cambian su estado de oxidación. Una especie se reduce a expensas de otra que se oxida.
1 mol = 6.022045x10 a la 23, Núm de Avogadro
Termodinámica: "Ciencia que nos ayuda a estudiar la transformación energética"
Ciencia que describe y relaciona las propiedades físicas de la materia y sus intercambios de energía. Estudia los procesos donde hay transferencia de enrgía en forma de calor y trabajo.
Bioenérgetica: "Forma en que los organismos adquieren, canalizan y utilizan la energía".
Calor (Q): Energía cinética total de todos los átomos o moléculas de una sustancia. Unida de medida: Joules o calorías.
1 cal = 4.186 J
Capacidad caloríca: Se define como la cantidad de calor que se requiere para elevar la temperatura de una sustancia 1 grado centigrado.
Energía: Capacidad de producir cambio y se mide por la cantidad de trabajo realizado durante este periodo de cambio. Se mide en Joules o calorías.
- Energía Potencial: Indica la cantidad de trabajo que se puede realizar al liberar la energía que se encuentra almacenada en un lugar.
- Energía de Combustión: Energía contenida en los enlaces de carbono de los combustibles, y que resulta liberada en el proceso de combustión (oxidación).Un combustible es cualquier material capaz de liberar energía cuando se quema, lo que transformará su estructura química.
- Energía química: Se obtiene como resultado de la ruptura de los enlaces que mantienen unidos los átomos que conforman una molécula de determinada sustancia. Se origina mediante la reacción de compuestos químicos.
- Energía cinética: Asociada a los cuerpos en movimiento.
Sistemas biológicos
- Sistema: Parte del universo que elegimos para el estudio. Toda parte del universo que se delimita mentalmente, es decir, la porción de materia cuyas propiedades se estudian. P.e; La célula.
- Ambiente: Todo lo que rodea al sistema constituye el ambiente o entorno. Todo lo que no pertenece al sistema, sus alrededores.
- Universo: Conjunto formado por sistema y entorno.
En una reacción química, las sustancias que intervienen constituyen el sistema termodinámico, que evoluciona desde un estado inicial (reactivos) a uno final (productos). El entorno será el medio donde tenga lugar la reacción. El universo será el conjunto de los reactivos y productos presentes en una solución y la atmósfera circundante.
Según su relación con el entorno, pueden ser:
- Aislados: No intercambian materia ni energía con el entorno y no produce efectos observables sobre el exterior. P.e. Sólo en practicas de laboratorio.
- Cerrado: Intercambian energía pero no materia con el entorno. P.e. Un chocolate que se derrite.
- Abierto: Intercambia energía y materia. P.e. La célula.
Energía interna: Función del estado de un sistema (momento en que la reacción se estructura y realiza intercambio de energía.
Estado termodinámico: Se define mediante la indicación de las cantidades de todas las sustancias presentes y 2 cualesquiera de las 3 variables siguientes; Temperatura (T), Presión sobre el sistema (P) y el volumen del sistema (V).
Fenómenos que incluyen la energía interna de un sistema
- La energía de movimiento de los átomos y moléculas
- Su energía de vibración y rotación
- La energía almacenada en los enlaces químicos
- La energía almacenada en interacciones no covalentes
- Todo tipo de energía
Formas de intercambio de energía
- Designamos el calor mediante el símbolo "q".
+ q = El sistema absorbe calor
- q = El sistema libera calor
- Designamos el trabajo con el símbolo "w".
+ w = El sistema realiza trabajo sobre sus alrededores
- w = Los alrededores realizan trabajo sobre el sistema
Entropía y entalpía
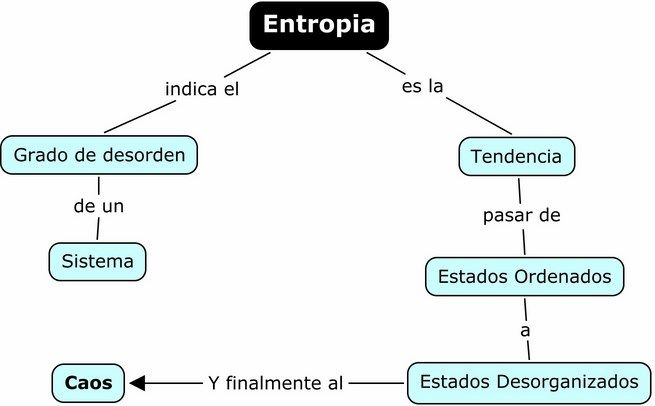
- Entropía: Medida del grado de aleatoriedad/desorden de un sistema. Forma de medir el caos.
- Entalpía: Contenido de calor interno del sistema reaccionante a presión constante. Relacionada con la energía interna. Calor que se desarrollo en una reacción a presión constante es igual a la entalpía. △ H = △ E (Entalpía es igual a energía interna)
△ H negativa = La reacción desprende calor = Exotérmico
△ H positiva = La reacción absorbe calor del entorno = Endotérmico
1era Ley de la Termodinámica "La energía no se crea ni se destruye, sólo se transforma"
La energía de un sistema sólo puede modificarse mediante intercambio de calor o trabajo con el entorno, por lo que el cambio de energía interna viene dado por:
△ E = q - w
w = P (presión) △(suma) V (volumen)
E = q - (P△ V)
2da Ley de la termodinámica "El universo tiende siempre a alcanzar un mayor grado de libertad. En todos los procesos naturales la entropía del universo (sistema + entorno) aumenta".
La entropía de un sistema aislado tenderá a aumentar hacia un valor máximo.
Energía libre de Gibbs
- Definida como △ G = - △ S universo
- Se ocupa sólo de las variaciones del sistema, sin necesidad de medir el entorno.
- Permite predecir la dirección de las reacciones químicas, posición exacta en el equilibrio y cantidad de trabajo que pueden llevar a cabo a temperatura y presión constantes.
- En todos los procesos espontáneos la energía libre del sistema disminuye, el valor final de G es menor que el inicial y por tanto, △ G es negativa y se dice que la reacción es exergónica. Cuando la variación de energía libre es positiva, entonces será endergónica.
- "La energía libre es la energía necesaria para producir trabajo a T (temperatura) y P (presión) constantes".


No hay comentarios:
Publicar un comentario