Soluciones acuosas
1) Ion: Átomo o molécula cargado eléctricamente, debido a que ha ganado o perdido electrones de su dotación normal, lo que se conoce como ionización. También suele llamársele molécula libre.
2) Anión: Ion cargado negativamente por ganancia de electrones.
3) Catión: Ion con carga eléctrica positiva. Cuando un átomo pierde electrones (los electrones de sus orbitales más externos, también llamado de Valencia), adquiere, una carga positiva neta.
Electrolito
Sustancia que contiene aniones y cationes y por lo tanto es capaz de conducir la corriente eléctrica. La mayoría de los electrolitos son ácidos, bases o sales en solución.
- Se puede obtener un electrolito mediante la disolución de un polímero, ya sea biológico (ADN) o sintético, y en estos casos se obtendrá un polielectrolito.
- Si tomamos una sal y la disolvemos en agua, los iones que componen la sal se separaran, en un proceso llamado solvatación, en donde cada anión y catión se rodean de moléculas de agua; el resultado es un electrolito.
- Electrolito: Sustancia que disuelta en agua conduce la electricidad gracias a los iones que quedan en solución -> Fuertes (se obtienen disolviendo en agua una sustancia que se disocia casi completamente en iones) / Débiles (se obtienen cuando la sustancia disuelta tiene poco porcentaje de disociación)
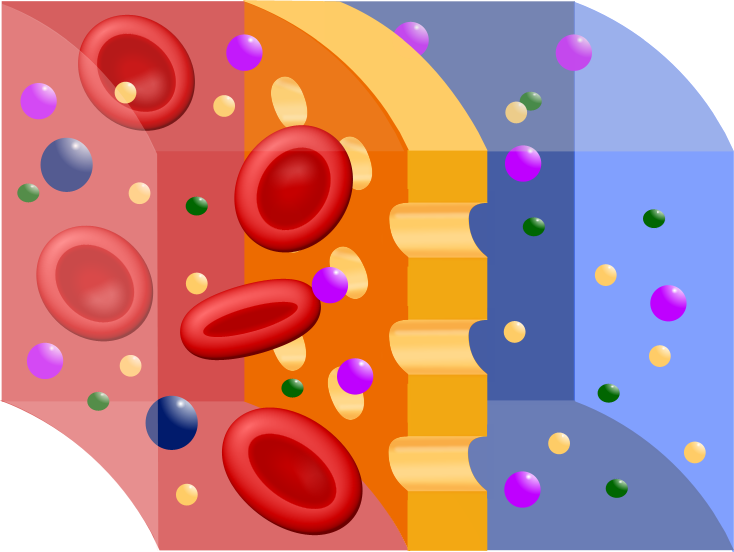
- Iones más importantes que forman parte de electrolitos en el organismo: Sodio, Potasio, Calcio, Cloruro, Magnesio, Bicarbonato e Hidrogeno Fosfato.
El equilibrio de electrolitos en el medio intra y extracelular es fundamental para las funciones básicas del organismo (contracción muscular, conducción nerviosa, respiración, etc). De este equilibrio también depende el pH sanguíneo y la excreción o retención de agua a nivel renal.
- Canales ionicos: Proteínas especiales insertadas en la membrana celular que permiten a los electrolitos entrar o salir de las células en forma de iones como el sodio, calcio y potasio.
- El equilibrio electrolitico está mantenido gracias a la acción de la hormona anti-diurética, la aldosterona y la paratormona.
Anfolito
Sustancias que presentan un carácter ácido y básico según las condiciones. Dícese de un cuerpo que puede comportarse como un ácido o una base. Si son sustancias neutras se denominan antóferos (Agua); se usa anfolito para los iones.
Movimiento de líquidos
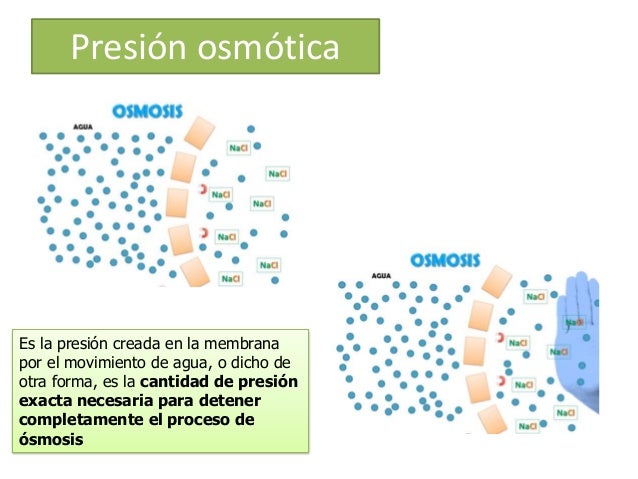
1) Ósmosis: Movimiento del agua a través de membranas celulares. La dirección del flujo va desde la solución menos concentrada a la de mayor concentración. Paso de solvente a través de una membrana semipermeable para igualar concentraciones.
"Pasaje de un disolvente, entre dos disoluciones que están separadas por una membrana con características de semipermeabilidad".
2) Diálisis: Es el método de separación liquido-liquido, similar a la ósmosis, porque son dos líquidos de diferente concentración separados por una membrana semipermeable en el que la solución más concentrada atraviesa la membrana para diluirse con la menos concentrada y así estar ambas concentraciones con la misma concentración.
La diálisis es el proceso de extracción de los productos de desechos y del exceso de agua en el cuerpo. Hay dos métodos de diálisis: la hemodiálisis y la diálisis peritoneal.
Hemodiálisis: Se extrae la sangre del cuerpo y se bombea al interior de un aparato que filtra las sustancias tóxicas, devolviendo a la persona la sangre purificada. La cantidad de líquidos devueltos se pueden ajustar.
Diálisis peritoneal: Se infunde dentro de la cavidad abdominal un líquido que contiene una mezcla específica de glucosa y sales que arrastra las sustancias toxicas de los tejidos. Luego se extrae el líquido y se desecha.
Diferencia entre Ósmosis y Diálisis
La ósmosis es el paso de las moléculas de disolventes a través de la membrana, de un lugar menos concentrado a otro más concentrado.
3) Osmolaridad: Medida de una concentración de una solución. Describe el núm. de partículas en solución. Osmolaridad (mOsmol/L)
Calculo de osmolaridad plasmática = 2 x Na + (Glucosa + Urea / 18)
- Soluciones Isotónicas (Sueros): Tienen la misma concentración de solutos que el plasma sanguíneo. Aquellas donde la concentración del soluto es la misma en ambos lados de la membrana (dentro y fuera) de la célula por lo tanto la presión osmótica en la misma disolución isotónica es la misma que los líquidos del cuerpo y no altera el volumen de las células.
- Soluciones Hipotónicas: Tienen una concentración de solutos menor que el plasma sanguíneo. Contiene baja concentración de soluto en relación con la concentración del citoplasma. En este caso, el agua se difunde desde la solución al interior de la célula, el volumen de la célula iría aumentando y podría llegar a explotar.
- Soluciones Hipertónicas: Tienen una concentración de solutos mayor que el plasma. Si una membrana semipermeable separa una solución con una concentración más elevada de sustancias disueltas de otra con una concentración menor de solutos.
Las soluciones se mueven a través de las membranas celulares de una solución menos concentrada a la más concentrada.
Presiones de los líquidos
1) P. Osmótica: Cantidad de líquidos requerida para detener totalmente o prevenir el flujo osmótico del agua entre 2 soluciones.
2) P. Oncótica: Es la fuerza de tracción ejercida por los coloides (por ejemplo, albúmina en plasmas) que ayuda a mantener el contenido de agua de la sangre en el espacio intravascular.
3) P. Hidrostatica: Presión ejercida por un líquido dentro de un sistema cerrado. Fuerza ejercida por la sangre en contra de las paredes vasculares.
Soluciones molares: Aquellas que en 1 litro de agua hay disuelto el peso molecular de la sustancia expresada en gramos. Núm de moles de soluto x litro de solución.
M= Moles / Volumen total de la solución
Soluciones normales: Número de equivalentes del soluto x litro de solución. Aquellas que en 1 litro de agua hay disuelto el peso molecular de la sustancia expresada en gramos dividido x el núm de electrones que intercambia en la reacción que se va a utilizar.
N= Núm de equivalentes / Volumen total de la solución
Soluciones molales: Número de moles expresados en el peso del disolvente. La molalidad no esta en función del volumen por lo tanto es independiente de la temperatura y la presión.
m= moles del soluto / Peso del disolvente
Soluciones porcentuales: Aquellas cuya medida es la cantidad de mililitros o gramos referidos a 100 ml de solución (no de solventes). Indican la cantidad de soluto disuelto en 100 partes de solución. Hay 3 tipos:
- Masa/masa= masa del soluto x cada 100 unidades de masa de la disolución. Se usa para expresar sólidos disueltos en líquidos.Porcentaje en masa = g de soluto / g de soluto + g de solvente x 100
- Masa/volumen= Expresa las concentraciones como gramos de soluto x 100 ml de solución. Porcentaje de masa sobre volumen = g de soluto / ml de solución x 100
- Volumen/volumen= Volumen de un líquido en 100 ml de la solución. Porcentaje en volumen= Volumen de líquido en cuestión / Volumen total de solución x 100



No hay comentarios:
Publicar un comentario