Regulación de la concentración de iones hidrógeno (equilibrio ácido - base)
Ácido -> MOLÉCULA CAPAZ DE DONAR UN PROTON
Átomo o molécula capac de aceptar un par de electrones (aporta protones)
a) Ácido fuerte: Aquel que cede H+ con facilidad y en solución acuosa está totalmente disociado (AH).
AH ------> A- + H+
b) Ácido débil: Cede sus H+ con dificultad y se disocia poco en solución acuosa (aH).
aH ----> a + H+
<----
Base -> MOLÉCULA CAPAZ DE ACEPTAR UN PROTÓN (NEGATIVO)
Átomo o molécula con un par de electrones no ocupados en enlace que puede donar (capta protones).
a) Base fuerte: Es aquella que acepta los H+ con facilidad y en presencia de una cantidad suficiente de H+ está completamente protonada.
B+H -----> BH+
b) Base débil: (b) acepta con dificultad los H+ y sólo está protonada parcialmente.
b + H+ -----> bH+
<-----
- Los ácidos y bases débiles p.e. H3CO3 (ácido carbonico); se disocian parcialmente (HCO3, H2O, CO2)
- Los ácidos y bases fuertes p.e. HCL (ácido clorhidrico); se disocial completamente
Los ácidos al disociarse producen BASES y las bases al aceptar H+ forman ÁCIDOS
Reacción de ionización del agua
El agua pura tiene la capacidad de disociarse en iones, por lo que en realidad se puede considerar una mezcla de agua molecular (H2O), protones hidratados (H3O+) e iones hidroxilo (OH-). En realidad esta disociación es muy débil en el agua pura y así, el producto ionico del agua es:
"Producto de la concentración de iones hidronio (H3O+) por la concentración de iones hidroxilo (OH-) se le denomina 'producto ionico del agua' representado como Kw. Las concentraciones de los iones H+ y OH se expresan en moles/litros"
PH (Potencial de hidrógeno)
- Soren Sorensen
- CONCENTRACIÓN DE IONES HIDRONIO (hidrógeno)
- Parámetro usado para medir el grado de ácidez o alcalinidad de las sustancias
- Logaritmo negativo de base 10 de la actividad de los iones hidrógeno
La escala de pH va desde 0-14 = Escala de Pauling
Valores menores que 7 (- que 7) indican el rango de ácidez.
Valores mayores que 7 (+ que 7) indican el rango de alcalinidad o basicidad.
Valor 7 (=) es considerado neutro.
o pH= -log [H3O]
Potencial oxhidrilo: pOH= -log [OH-]
Amortiguadores "buffer" o tampones
Evitan cambios de pH
Sistemas encargados de evitar grandes variaciones del valor del pH. Son por lo general soluciones de ácidos débiles y de sus bases conjugadas o de bases débiles y sus ácidos conjugados.
La sangre y tejidos contienen sistemas tampón que reducen al mínimo los cambios en la concentración de ion hidrógeno [H+]
- Bicarbonato; principal amortiguador que neutraliza los iones H+ / Hemoglobina
- Neutralizado también por tampones intracelulares; proteínas y fostatos
"Una solución amortiguadora es aquella que se opone a los cambios de pH cuando se agrega ácido o álcali. Tales soluciones se usan en muchos experimentos bioquímicos en los cuales se necesita controlar exactamente el pH"
Amortiguadores + importantes del cuerpo:
PO4 = Fosfato
Ácido carbónico = H2CO3 (HCO3: Bicarbonato / CO2: Dióxido de carbono)
P+ = Proteínas
Tampón bicarbonato
Permanece en equilibrio con el aire atmosférico creando un sistema abierto con una capacidad superior. El dióxido de carbono producido en el metabolismo se difunde a través de las membranas celulares y se disuelve en el plasma.
El tampón bicarbonato minimiza los cambios en la concentración del ion hidrógeno cuando se añade a la sangre un ácido o un alcalí.
- Cuando se añade un ácido, este reacciona con el bicarbonato
- Cuando se añade una base, OH-, este reacciona con el ácido carbonico y genera agua. La concentración de bicarbonato en plasma aumenta ligeramente.
- El pK (valor del pH de una solución amortiguadora en el que el ácido y base se encuentran a concentraciones equimoleculares 50%/50%) del tampón es 6.1
- La concentración plasmatica de bicarbonato esta controlada por riñones y eritrocitos, se denomina componente métabolico del equilibrio ácido-base. La regulación del bicarbonato corresponde al riñon.
- La disminución de CO2 se compensa con la reducción de la velocidad de la respiración.
Defectos en el control renal del bicarbonato y de los iones [H+] ocasionan un grupo de enfermedades conocidas como acidosis tubulares renales (ATR) que pueden ser:
1) Distal: Alteración de la excreción de iones [H+] en el túbulo distal
2) Proximal: Alteración de la reabsorción de bicarbonato (síndrome de Falconi)
Ecuación de Henderson-Hasselbach: Describe el comportamiento del tampón bicarbonato; expresa la relación entre pH y los componentes del tampón bicarbonato:
pH = pK + log [Bicarbonato] / pCO2 x 0.23
Coeficiente de solubilidad del CO2 en plasma = 0.23
Tamponamiento intracelular
- Principalmente:
1) Proteínas y 2) Fosfatos
- Los iones [H+] penetran en las células en intercambio con el potasio [K].
Reducción de iones [H+] plasmaticos o un exceso de bicarbonato serán tamponados por los iones [H+] derivados de las células. Los iones [H+] entrarían en el plasma a cambio del potasio, reduciendo la concentración plasmatica de potasio.
- Acidemia: (Bajo pH plasmático) puede asociarse con hiperpotasemia (nivel elevado de potasio plasmático, por encima de 5.5 mmol/L)
- Alcalemia: (pH en sangre elevado) con hipopotasemia (descenso de niveles de potasio en el plasma por debajo de 3.5 mmol/L)
Trastornos ácido-base
El concepto de los componentes respiratorios (CO2) y metabólico (bicarbonato) del equilibrio ácido-base es la base para la clasificación de trastornos clínicos.
Acidosis: Proceso que lleva a la acumulación de iones [H+]
Alcalosis: Ocasiona una disminución de iones [H+]
Gasometría: Medición de la cantidad de oxígeno y dióxido de carbono en sangre.
Medición de gases en un fluído cualquierda. En medicina se puede realizar una gasometría en cualquier líquido biológico, pero donde mayor rentabilidad diagnóstica tiene es en la sangre; pudiendose realizar en sangre venosa periférica, sangre venosa central y sangre arterial. Sirve para evaluar el estadio del equilibrio ácido-base y conocer la situación de la función respiratoria.
Constantes fisiológicas
pH de sangre arterial= 7.35 (acidosis) - 7.45 (alcalosis)
pH de sangre venosa= 7.30 - 7.40
pH de orina= 5.5
pH de piel= 5
pH de estómago= 3
Valor normal de HCO3 (bicarbonato) en sangre= 22 - 28
Valor normal de CO2 (dióxido de carbono)= 38 - 42 mmHg
Al día los riñones filtran 180 litros de sangre
Anhidrasa carbónica (enzima) (H2CO3) destruye al ácido carbonico y produce hidrógeniones.
H2CO3 (ÁCIDO CARBÓNICO)
Anhidrasa carbonica
Pulmón Riñón
CO2 + H2O HCO3 + H
(Dióxido de carbono) + (agua) (Bicarbonato) + (Hidrogeniones)
El riñón compensa al pulmón y el pulmón al riñón.
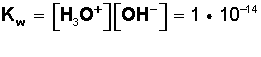






Hola, ¿podrías pasarme las referencias?
ResponderEliminar