Enzimas
Sustancias que ayudarán a que el organismo pueda de manera más rápida absorber los nutrientes de los alimentos en el cuerpo.
Características:
- Proteína catalizadora
- Captan energía del ATP
- Todos los nombres van a terminar en "asa"
- Funcionana en condiciones suaves de temperatura (25-70 g C) y pH (4-9)
- Necesita poca energía para funcionar
- Para destruir una proteína puedes utilizar agentes: químicos, físicos (calor) o biologícos (enzimas)
- Catalizador biológico
- Pertenece a la familia de las proteínas
- No se altera ella misma en el proceso global
- Aumentan la velocidad inicial de una reacción química
- Termosensibles
- Hidrosolubles
Catalizador: Sustancia capaz de hacer que un sistema químico alcance más rápidamente su estado de equilibrio sin alterar las propiedades de dicho equilibrio ni consumirse en el proceso.
Sustrato: Sustancia sobre la que actua la enzima. Puede ser:
- Natural; Tiene actividad de máxima eficacia
- Análogo; Actividad de menor eficacia
Ribozimas: Son moléculas de RNA con actividad enzimática, las cuales catalizan el corte de un ARNm, naciente o transcrito primero.
Coenzimas: Pequeñas moléculas orgánicas no proteicas que transportan grupos químicos entre enzimas. Es esencial para la actividad biológica de la enzima, la mayoría derivan del grupo de vitaminas B.
Las enzimas están unidas a otras moléculas que le ayudarán a ser más eficiente:
- Apoenzima: Fracción proteica no activa. Proteína que cuando se encuentra aislada de su cofactor es inactiva enzimaticamente.
- Cofactor: No proteica. Requieren de la apoenzima para ser activa. No esta unido fuertemente a la apoenzima.
- Grupo proteíco: Similar al cofactor pero este si se encuentra fuertemente unido a la apoenzima.
- Holoenzima: Enzima activa formada por la adición de cofactor o proteicos a la apoenzima. Complejo enzima-cofactor, activo cataliticamente.
Apoenzima (inactiva) + cofactor ------> Holoenzima (activa)
Nomenclatura de las enzimas
Trivial; Se convino llamar a las enzimas agregando el sufijo "asa" al sustrato. Ej: lactasa.
Nomenclatura recomendada; Es informativa y sencilla; indica sustrato y tipo de reacción. Ej: Glucosa Oxidasa
Nomenclatura sistemática; La Unión Internacional de Bioquímica y Biología Molecular (IUBMB) en 1964, sugiere el sistema de nomenclatura de las enzimas. Para este sistema, el nombre empieza con EC (clase de enzima) seguida de 4 dígitos.
1er dígito representa la clase
2do dígito significa la subclase
3er dígito subclase o subgrupo
4to dígito, número de enzima particular (oxireductasas, transferasas, etc)
Características de un sistema enzimático
Los sistemas enzimáticos están formados por la enzima propiamente dicha (apoenzima), el sustrato o los sustratos, un grupo proteico (coenzimas) y sustancias activiadoras.
1) Sitio activo: Es la zona de la enzima a la cual se une el sustrato, para que la reacción se produzca.
2) Número de recambio: Número de moléculas de sustrato convertidas en producto por unidad de tiempo.
3) Especificidad: Las enzimas son especificas para el sustrato y la reacción. Significa que pueden catalizar la transformación de apenas un sustrato o una familia de estos relacionados estructuralmente.
- Especificidad absoluta: Cuando la enzima sólo puede actuar sobre un tipo de sustrato. P.e: La deshidrogenasa succinia que es especifica para el succinato.
- Especificidad relativa: Puede actuar sobre sustratos con estructuras similares. P.e: La L-aminoacido oxidasa puede catalizar la oxidación de diferentes aminoácidos de la serie L.
4) Energía de activación: Energía requerida para convertir todas las moléculas de una sustancia reactiva desde un estado básico a uno de transición.
5) Estado de transición de una reacción: Rico en energía de las moléculas que interaccionan en la cima de la barrera de activación.
Mecanismos de unión de la enzima
Son 2; Complementariedad geométrica (según su forma) o Complementariedad electrónica (según sus cargas, sean positivas o negativas)
Inhibición enzimática
¿Qué es un inhibidor? Sustancia que previene que la reacción química ocurra o disminuye su velocidad de reacción aumentando su energía de activación. Los inhibidores enzimáticos son moléculas que se unen a enzimas y disminuyen su actividad.
- Reversibles: Se unen a la enzima de forma no covalente. Termina su ciclo y la enzima vuelve a funcionar.
- Irreversibles: Reaccionan con la enzima y cambian su estructura química.
Tipos de inhibidores:
- Isostérico: El inhibidor se une al mismo sitio que el sustrato (sitio activo).
- Alostérico: El inhibidor se une a un sitio diferente al que se une el sustrato (sitio alostérico). Hay 2 tipos de control alosteríco. 1) Heterotrópico; Un lugar para el activador y uno para el inhibidor y 2) Homotrópico; Lugar en común donde se inserta el activador y el inhibidor.
La inhibición específica de la acción enzimática puede ser de tipo reversible (competitiva, mixta y no competitiva) o de tipo irreversible (incompetitiva).
Competitiva:
En la Inhibición competitiva el sustrato (S) y el I compiten por la enzima libre,
pudiendo unirse uno o el otro, pero no ambos simultáneamente, hay una
interacción mutuamente excluyente del S y de I con la enzima. La unión de E a I
conduce a la formación de un complejo no productivo.
- Se puede revertir la inhibición añadiendo más sustrato
Competencia por ganar el sitio activo por parte del sustrato y el inhibidor.
Ej: Paracetamol, Quimioterapias moderanas, Bactrin
No competitiva:
El inhibidor y el sustrato se unen a la enzima en diferentes espacios. El inhibidor no competitivo no se une al sitio del substrato, sino a un grupo de la enzima, que es esencial para su función. La inhibición no competitiva no puede ser revertida por el substrato. Un ejemplo lo constituye la inhibición de algunas enzimas que contienen Fe, por el cianuro, el cual se combina reversiblemente con el átomo de Fe, dando una forma inactiva.
- Tipo de inhibición mixta donde el inhibidor se une con la misma afinidad a la enzima libre que al complejo enzima-sustrato (ES).
Mixta:
El inhibidor se puede unir a la enzima al mismo tiempo que el sustrato. Sin embargo, la unión del inhibidor afecta la unión del sustrato y viceversa.
- En inhibición mixta, el inhibidor se une a un sitio alostérico, es decir, un sitio diferente del sitio activo, donde el sustrato se une. Sin embargo, no todos los inhibidores que se unen a sitios alostéricos son inhibidores mixtos.
- Inhibición mixta puede resultar en una disminución en la afinidad aparente de la enzima para el sustrato en los casos en que el inhibidor favorece la unión de la enzima libre, o en un aumento en la afinidad aparente cuando el inhibidor se une favorablemente al complejo enzima-sustrato. En cualquiera de los casos la inhibición disminuye la velocidad de reacción enzimática aparente máxima.
Retroinhibición enzimática (Feedback negativo)
Función y clasificación de las enzimas
- Oxidoreductasas: Catalizan reacciones redox / Transferencia de hidrógenos o adición de oxígeno. P.e: Deshidrogenasas y peroxidasas
- Transferasas: Transfieren grupos funcionales. P.e: Hexocinasa y transaminasas
- Hidrolasas: Catalizan reacciones de hidrólisis / Ruptura de enlaces con adición de agua. P.e: Fosfato alcalina y tripsina
- Liasas: Rompen enlaces C-O, C-C y C-N / Ruptura sin adición de agua. P.e: Anhidrasa carbónica y deshidratasa
- Isomerasas: Reagrupan grupos funcionales / Puede producir isómeros ópticos, geométricos o posicionales de sustratos. P.e: Triosa-fosfato-isomerasa
- Ligasas: Juntan 2 moléculas ATP-dependientes. P.e: Piruvato-carboxilasa y DNA-ligasa
VITAMINAS HIDROSOLUBLES
Vitaminas: Sustancias órganicas que deben obtenerse en pequeñas cantidades a partir del ambiente porque los seres humanos no pueden sintetizarlas de nuevo o su velocidad de síntesis es inadecuada para la conservación de la salud. En su mayor parte la fuente ambiental es la dieta.
Se puede hacer una clasificación de ellas dependiendo de su solubilidad:
- Liposolubles: A, D, E y K; se absorben en el organismo con ayuda de grasas y aceites.
- Hidrosolubles: B y C; no necesitan grasa para su absorción, generalmente coenzimas o precuersores de ellas.
Vitaminas del complejo B (hidrosolubles)
B1= Tiamina / Beriberi, enfermedades en la piel
B2= Riboflavina / Enfermedades en piel, boca, lengua y fatiga
B3= Niacina / Pelagra (dermatitis, demencia)
B5= Ácido Pantotenico / Dermatitis, alteraciones metabolicas
B6= Piridoxina / Alteraciones del metabolismo proteico
B8= Biotina / Erupciones cutáneas, lesiones neurológicas
B9= Ácido fólico / Espina bífida, anemia meganoblástica
B12= Metilcovalamina / Anemia perniciosa
Vitamina C
Ácido ascórbico
Zimogenos
- Proenzimas (proteínas inactivas)
- Precursores inactivos de las enzimas
- Mecanismo de seguridad por factores físicos, químicos y metabolicos
- Necesitan la ayuda de otras enzimas y iones para poder funcionar
- No tienen actividad catalitica
- Activadores de zimogenos = Cofactores o coenzimas (iones métalicos y vitaminas), cambios de pH y otras enzimas
- Algunas enzimas que sintetizan los alimentos actúan como proenzimas para que no destruyan las células que las forman "mecanismo de conservación"
Ejemplo de un zimogeno:
Células del páncreas sintetizan una proenzima llamada Tripsinógeno que forma parte del jugo pancreatico. Llega al intestino delgado y una enzima (enteroquinasa) que se produce ahí, pierde el fragmento de su cadena péptidica y se transforma en una enzima "Tripsina" que ya contendrá actividad catalitica.
- En este caso, si la Tripsina se activa antes se produce una páncreatitis aguda, que produce la autodigestión del tejido pancreatico.
Isoenzimas
- Proteínas con diferente estructura pero que catalizan la misma reacción
- Su existencia permite el ajuste del metabolismo para satisfaces las necesidades particulares de un determinado tejido o etapa del desarrollo.
Ejemplo: Glucoquinasa (estructural; muscular) y Hexoquinasa (hepatica) -> I, II, IV, III (diferentes estructuras a la misma acción). Tienen diferente distribución tisular.
Modelo de Michaelis Menten
Explica el comportamiento hiperbólico de la velocidad con respecto a la concentración de sustrato.
En el modelo postularon que la enzima (E) se combina en primer lugar con el sustrato (S), de forma reversible, formando el complejo enzima-sustrato (ES), que se descompone en un segundo paso dando la enzima libre (E) y el producto (P). La velocidad de la última reacción es baja, y el modelo supone que la probabilidad de que la enzima reaccione con el producto para volver a formar (ES) es tan ínfima que resulta despreciable quedando simplicado este último paso en una reacción prácticamente irreversible.
ES ----> E+P
La enzima puede existir en 2 formas, en forma libre (E) o combinada (ES), cuando la (S) es baja la mayoría de la enzima estará libre y se verá favorecida la formación de (ES), cuando se va incrementando la (S) la velocidad aumenta linealmente. La (E) libre será la diferencia entre la (E) total o inicial y la (E) o enzima combinada con sustrato y la velocidad máxima se alcanzará cuando toda la enzima se encuentre en forma de (ES), llegándose a la saturación de la enzima por su sustrato.
Al disponer de una concentración de sustrato saturante, la reacción alcanza rápidamente un estado estacionario en el que la (ES) se mantiene prácticamente constante y la velocidad medida durante ese estado es la velocidad analizada por el modelo de Michaelis-Menten que también se denomina "modelo del estado estacionario". La expresión más habitual de la ecuación es:
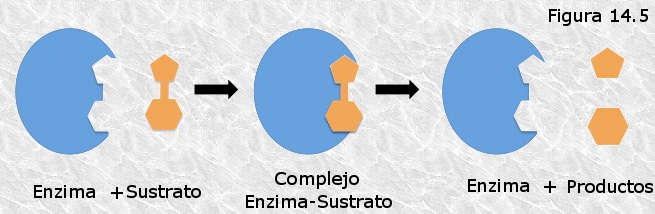
Sustrato, complejo enzima-sustrato
Sustrato: Moléculas de ligando, sobre la que actúa una enzima
Complejo enzima-sustrato: Enzima y sustrato se combinan de modo transitorio para formar un complejo enzima-sustrato en el que se alcanza el estrado de transición con mayor probabilidad que en la reacción no catalizada. Una vez alcanzado dicho estado, el complejo enzima-sustrato se descompone para dar lugar a los productos y la enzima libre.
La enzima, una vez liberada, puede combinarse con una nueva molécula de sustrato para formar un nuevo complejo E-S cerrándose así el ciclo catalítico de la enzima.
Producto: Resultados del complejo E-S
Estrategias de control de la actividad de enzimas
1) Concentración de enzima: La tasa de una reacción o su velocidad (v) es directamente proporcional a la concentración de la enzima, cuando hay suficiente sustrato. Esta propiedad es usada para determinar los niveles de una enzima en particular en plasma, suero o tejidos.
2) Concentración de sustrato: En la medida en que la concentración de sustrato aumenta, la velocidad también aumenta correspondientemente en las fases iniciales. Al agregar + sustrato, todas las moléculas de enzima están saturadas. Un mayor aumento de sustrato no causa efecto alguno en la velocidad de la reacción. La velocidad máxima obtenida es llamada Vmax y representa la máxima velocidad de reacción alcanzable en presencia de exceso de sustrato.
3) Regulación alostérica: Las enzimas alostéricas tiene un sitio catalitíco donde se une el sustrato y otro sitio alostérico separado donde se une el modificador. La unión de la molécula reguladora puede ya sea aumentar la actividad de la enzima o inhibirla. En el primer caso es conocido como modificador positivo y en el segundo como negativo.
4) Modificación covalente: La actividad enzimática puede ser aumentada o disminuida por modificación covalente; es decir, ya sea por adición de un grupo a la enzima mediante un enlace covalente, o removiendo un grupo por ruptura de un enlace covalente. La actividad de zimógenos por proteólisis parcial es un ejemplo.
Factores que afectan reacciones
- Temperatura: La velocidad de la reacción enzimática aumenta cuando la temperatura del medio es aumentada; alcanza un máximo y luego disminuye. La temperatura a la cual una máxima cantidad de sustrato es convertida en producto por unidad de tiempo es llamada "óptima". En medida que la temperatura aumenta las probabilidades de colisión también y la velocidad de las reacciones es mayor.
- pH: Cada enzima tiene un pH óptimo usualmente entre 6 y 8.

.jpg/450px-Complejo_enzima-sustrato_(llave-cerradura).jpg)






No hay comentarios:
Publicar un comentario